施福东教授团队:题目为“tPA Mobilizes Immune Cells that Exacerbate Hemorrhagic Transformation in Stroke”《Circulation Research》线上发表(5年影响因子:15.627)

原文链接
● Shi K, Zou M, Jia DM, Shi SX, Yang X, Liu Q, Dong Jf, Sheth KN, Wang X, Shi FD. tPA mobilizes immune cells that exacerbate hemorrhagic transformation in stroke. Circulation Research. 2020 Oct 19. doi: 10.1161/CIRCRESAHA.120.317596.
●https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA. 120.317596
脑卒中已成为我国第一位致死和致残原因,其中缺血性卒中占60%~70%。临床上组织型纤溶酶原激活物(tPA)溶栓以及机械取栓是目前缺血性脑卒中血管再通治疗的两大法宝。由于机械取栓对于设备以及人员技术要求高,静脉溶栓依然是卒中后血管再通的主要治疗方式。而临床上tPA溶栓治疗展现出双刃剑作用:仅在4.5小时时间窗内能有效溶解血栓,同时显著增加溶栓后患者脑出血风险,因此仅有3%的卒中患者获益。
静脉溶栓 分秒必争
急性缺血性卒中发生后,在梗死核心区周围已发生缺血但尚未坏死的脑组织形成缺血半暗带,是急性期再通治疗可挽救的主要脑组织。通常缺血半暗带仅存活数小时,是溶栓时间窗狭窄的主要原因。既往研究者提示卒中后缺血区域脑组织血脑屏障完整性受到破坏,血管再通后血液成分从破坏的血脑屏障进入脑实质,造成出血转化。但是出血转化的确切机制并不清楚。阐明卒中后狭窄的tPA溶栓时间窗和溶栓后增加的出血风险的机制,将使更多患者受益于tPA治疗,具有重大的理论和实践意义。
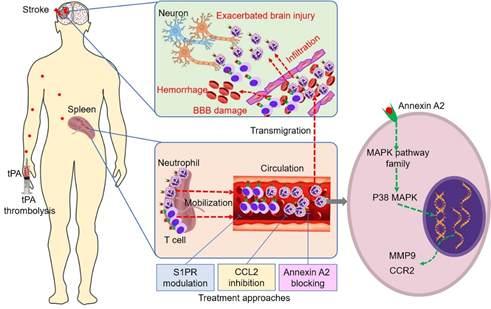
△(图1)tPA溶栓后出血转化的免疫机制及干预策略。
精准免疫干预,减轻溶栓治疗出血风险
为解决这些难题,施福东教授团队建立了急性缺血性卒中tPA静脉溶栓治疗前瞻性研究队列,纵向比较了71例接受tPA静脉溶栓治疗的急性脑卒中患者,溶栓前后外周血免疫细胞的变化,发现tPA快速升高外周血中性粒细胞和淋巴细胞数目。为明确其机制及其对溶栓后出血转化的影响,团队使用大鼠血栓栓塞性脑卒中模型进行了深入探索,发现tPA通过作用于表达annexin A2的免疫细胞,调控这些细胞的转录组基因表达,迅速活化外周免疫细胞,进而加重血脑屏障破坏,促进溶栓后出血转化。靶向鞘磷脂-1-磷酸受体(S1PR)或CCR2配体(CCL2)的免疫干预,可以显著降低脑栓塞后溶栓的出血风险,并改善神经功能(图1)。该研究于2020年10月19日在线发表于Circulation Research,证实精准免疫干预可能降低缺血性脑卒中患者接受溶栓治疗的出血转化风险,为解决这一临床难题提供了新的治疗策略。
tips:tPA溶栓快速激活并动员外周中性粒细胞和T细胞向缺血脑组织迁移,加重脑血管炎症、血脑屏障破坏和出血转化。tPA与免疫细胞的annexin A2结合,激活细胞内MAPK信号通路,导致基质金属蛋白酶9(MMP9),C-C趋化因子受体2(CCR2)等表达上调。靶向中性粒细胞趋化因子和鞘磷脂-1-磷酸受体(S1PR)的免疫干预通过抑制免疫细胞的迁移,减轻tPA对免疫细胞的活化,从而减轻血脑屏障的破坏,以及溶栓后出血转化(Circulation Research 2020)。
施福东团队2018年联合免疫调节剂和tPA扩大急性缺血性脑卒中溶栓时间窗的研究为WILEY出版社年度最高被下载论文

大量实验奠定基础,tPA溶栓时间窗扩展至6小时
该研究是施福东教授团队探索免疫干预作为联合用药治疗急性脑卒中的延续。自2014年始,团队通过两项临床研究,验证了免疫调节剂芬戈莫德(Fingolimod)联合tPA溶栓治疗急性缺血性脑卒中,显著降低溶栓相关的出血转化并扩大溶栓时间窗。
芬戈莫德作为口服免疫调节剂,阻止淋巴细胞从次级淋巴器官向外周的迁移,从而减轻其脑内浸润。施教授团队的两项临床概念验证性研究及多项临床前研究均证实芬戈莫德可以抑制脑卒中患者的脑内炎症并减轻继发性脑损伤(PNAS 2014, JAMA Neurology 2014)。急性缺血性卒中发病4.5小时内,联合芬戈莫德和tPA治疗安全可行,并减少了患者出血转化(Circulation 2015),为上述深入机制研究奠定了基础。芬戈莫德还可以通过减轻卒中后血管炎症、促进脑微循环灌注以及侧枝循环建立,而保护缺血半暗带,将tPA的溶栓时间窗扩展至6小时 (Annals of Neurology 2018)。
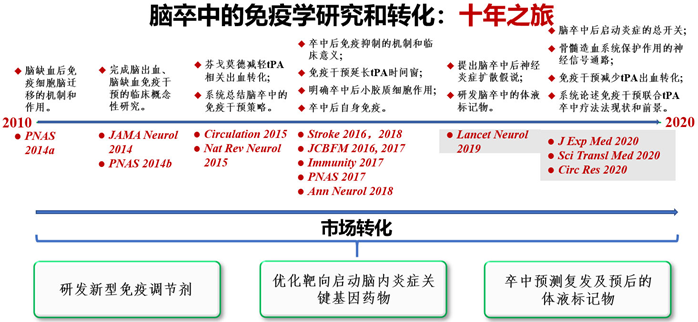
问渠那得清如许为有源头活水来2010-2020十年内施福东教授团队在脑卒中免疫机制和免疫干预方面完成了一系列临床与基础研究有机融合的开拓性探索系列研究成果成为该团队获得天津市自然科学一等奖两次中国卒中奖和市场转化的基础在脑卒中急性期治疗的困境中,卒中免疫学应运而生,为卒中发病机制提供了的新视角和线索,同时也为免疫干预作为单药或者联合用药治疗卒中的探索,奠定了理论基础和带来了全新治疗的曙光。

△完成此项工作的主要成员(从左至右)史凯斌、贾冬梅、施福东、邹明,2020年10月19日在天津总医院
参考文献及链接
1. ShiK, Zou M, Jia DM, Shi SX, Yang X, Liu Q, Dong Jf, Sheth KN, Wang X, Shi FD. tPAmobilizes immune cells that exacerbate hemorrhagic transformation in stroke.Circulation Research, 2020 Oct 19. doi: 10.1161/CIRCRESAHA.120.317596.https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.120.317596
2. TianDC, Shi K, Zhu Z, Yao J, Yang X, Su L, Zhang S, Zhang M, Gonzales RJ, Liu Q,Huang D, Waters MF, Sheth KN, Ducruet AF, Fu Y, Lou M, Shi FD. Fingolimod Enhances the Efficacy of Delayed Alteplase Administration in Acute Ischemic Stroke by Promoting Anterograde Reperfusion and Retrograde Collateral Flow.Ann Neurol. 2018;84(5):717-728. https://onlinelibrary.wiley.com/doi/full/10.1002/ana.25352
3. ZhuZ, Fu Y, Tian D, Sun N, Han W, Chang G, Dong Y, Xu X, Liu Q, Huang D, Shi FD.Combination of an immune modulator fingolimod with alteplase in acute ischemic stroke. Circulation. 2015;132(12):1104-1112. https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.115.016371
4. FuY, Zhang N, Ren L, Yan Y, Sun N, Li YJ, Han W, Xue R, Hao J, Yan Y, Yu C, ShiFD. The impact of an immune modulator fingolimod on ischemic stroke. Proc Natl Acad Sci USA. 2014;111:18315-20. https://www.pnas.org/content/111/51/18315
5 FuY, Hao J, Zhang N, Ren L, Sun N, Li YJ, Yan Y, Yu C, Shi FD. Fingolimod for treatment of intracerebral hemorrhage: a two-arm proof-of-concept study. JAMA Neurology. 2014;71:1092-101. https://jamanetwork.com/journals/jamaneurology/fullarticle/1885713